生体運動研究室
我々はよく、動いているものを「生きているようだ」と表現する。学術的にも、生き物は必ず動いている。巨視的な点については言うまでもないが、細胞内の分子も、正しい場所で正しい時間に機能するためには、「動く」必要がある。生体内の様々な反応に関わる「物質」だけでなくその反応が起こる「時間」と「場所」を決めることが生命現象には必須であり、この立場から、「動く」ことの研究は「生物物理学」の中心的課題であると考えている。我々は、生体内の「動く」メカニズムを分子レベル解明し、新しい動作原理を見出すと共に、その機能の工学的応用を試みている。
スタッフ
 教授 本多 元
教授 本多 元  准教授 藤原 郁子
准教授 藤原 郁子 研究プロジェクト
- 生体運動の分子機構解明 ~力学的情報の立場から~
- 細胞内にある膨大な分子が協調して正確に機能するためには、分子相互の連携が必須です。この意味で分子の運動をその連携機能の点から解明することは大変重要です。本研究室では運動性タンパク質、アクチン・ミオシンを用いて、複数のタンパク質分子がお互いに連携していくメカニズムの解明を目指しています。アクチン繊維や、その構成分子は顕微鏡で直接観察できます。強力な熱ゆらぎにさらされている分子同士がどのように協調しているかを、「分子ゆらぎ解析」の手法を用いて研究を進めています。
- LSI とモータータンパク質によるバイオデバイス開発
- 実験室で行う酵素・化学反応はすべて複数の溶液を混合することで開始されています。しかし、細胞内で起こるさまざまな化学反応においては、その体積の小ささから「液体の混合」は不可能です。代わりに細胞内では、モータータンパク質がこの役割を担っています。溶液の混合ではなく分子の輸送により反応を制御することにより、反応装置の超小型化が容易に実現できます。本研究室では、この機構を利用して新たなバイオデバイスの開発を試みています。
- アクチン結合タンパク質による、重合制御のメカニズム解明
- 細胞は、膜で閉じた系になっています。その中で、限られた量のアクチンを上手く使い回して細胞の骨として機能させつづけるために、100種類以上もの因子が関与しています。因子の結合部位や機能は様々で、アクチン線維の内部状態によって、結合するタイミングが決定されるタンパク質もあります。 私たちは、蛍光染色したアクチン線維1本に各因子を加えて相互作用を顕微鏡でリアルタイムに観察することによって、アクチン細胞骨格の制御機構を分子レベルで明らかにしようとしています。
- アクチン重合・脱重合ダイナミクスに作用する薬剤の影響の分子機構の解明
- 細胞の動きを止めるため、アクチンに結合する阻害剤があります。これら阻害剤は、分光器を用いた溶液実験とタンパク質の構造解析で調べられたデータが殆どで、詳細な阻害のメカニズムが分かってないものが多い状態です。 私たちは1本のアクチン線維の重合・脱重合の最中に阻害剤を加えることで、どのようにアクチンに作用するのかを分子レベルで明らかにしています。
- バクテリアのアクチン様タンパク質MreBの重合ダイナミクスとその役割の解明
- バクテリアの中にもアクチンに似たタンパク質があり、MreBと呼ばれます。MreBは今まで、硬い細胞壁の合成酵素の一部として、細胞内膜上を移動すると考えられてきましたが、最近、別の機能があることが示唆されてきています。バクテリアの中において、アクチン様タンパク質MreBがどのような機能をもつのか、未解明なことばかりの研究分野に挑戦しています。
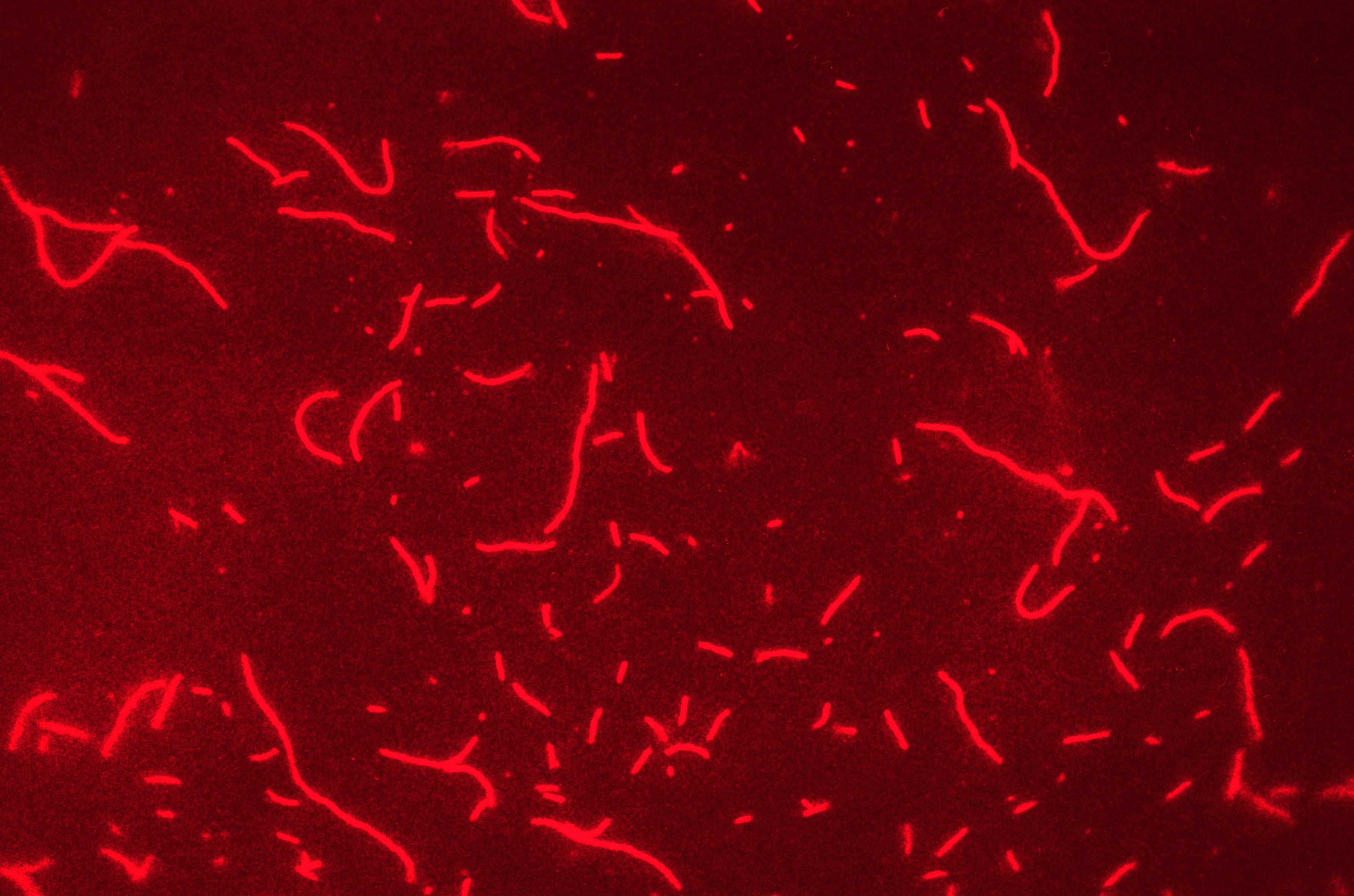
図1:アクチン繊維の顕微鏡写真
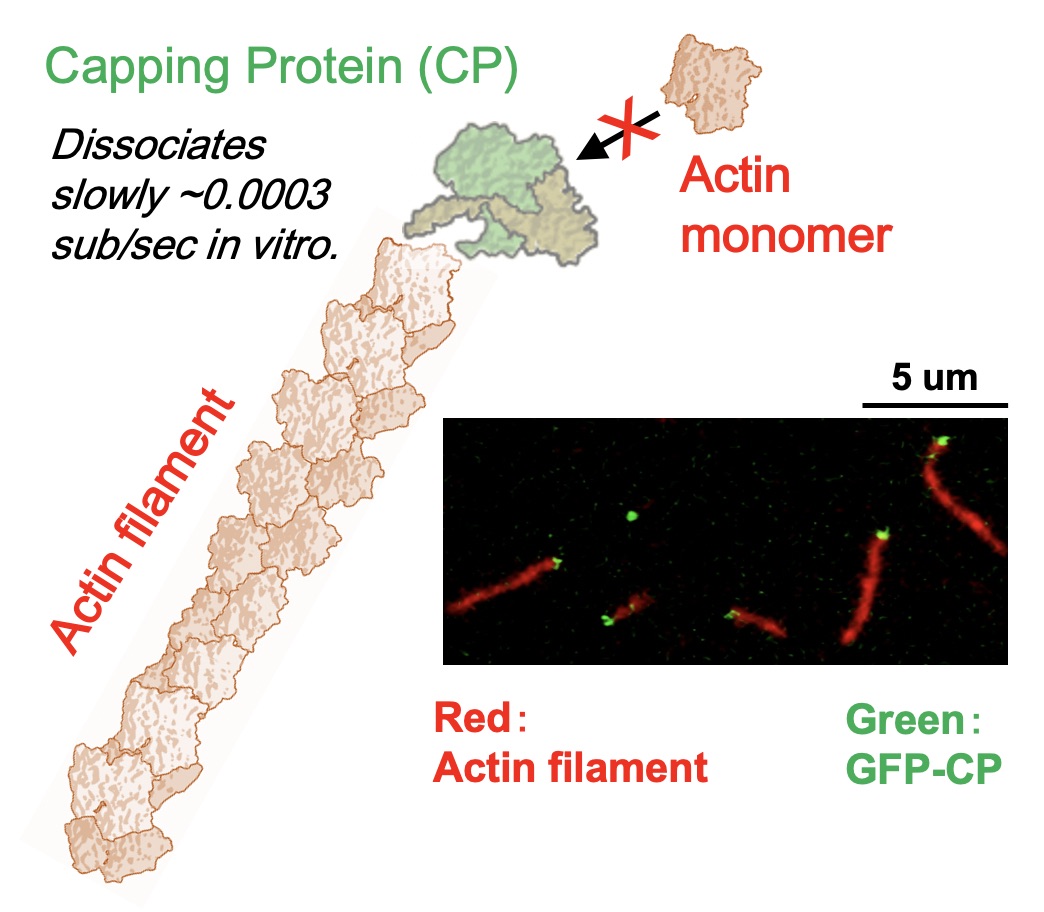
図2:アクチン結合タンパク質Capping protein(緑)が、アクチン線維(赤)の速く伸長する端に結合・阻害している様子を示すイラストと蛍光顕微鏡像。このCapping
proteinは一度つくと約30分間離れないほど(k off = 0.0003 sub/sec)、強く結合する。
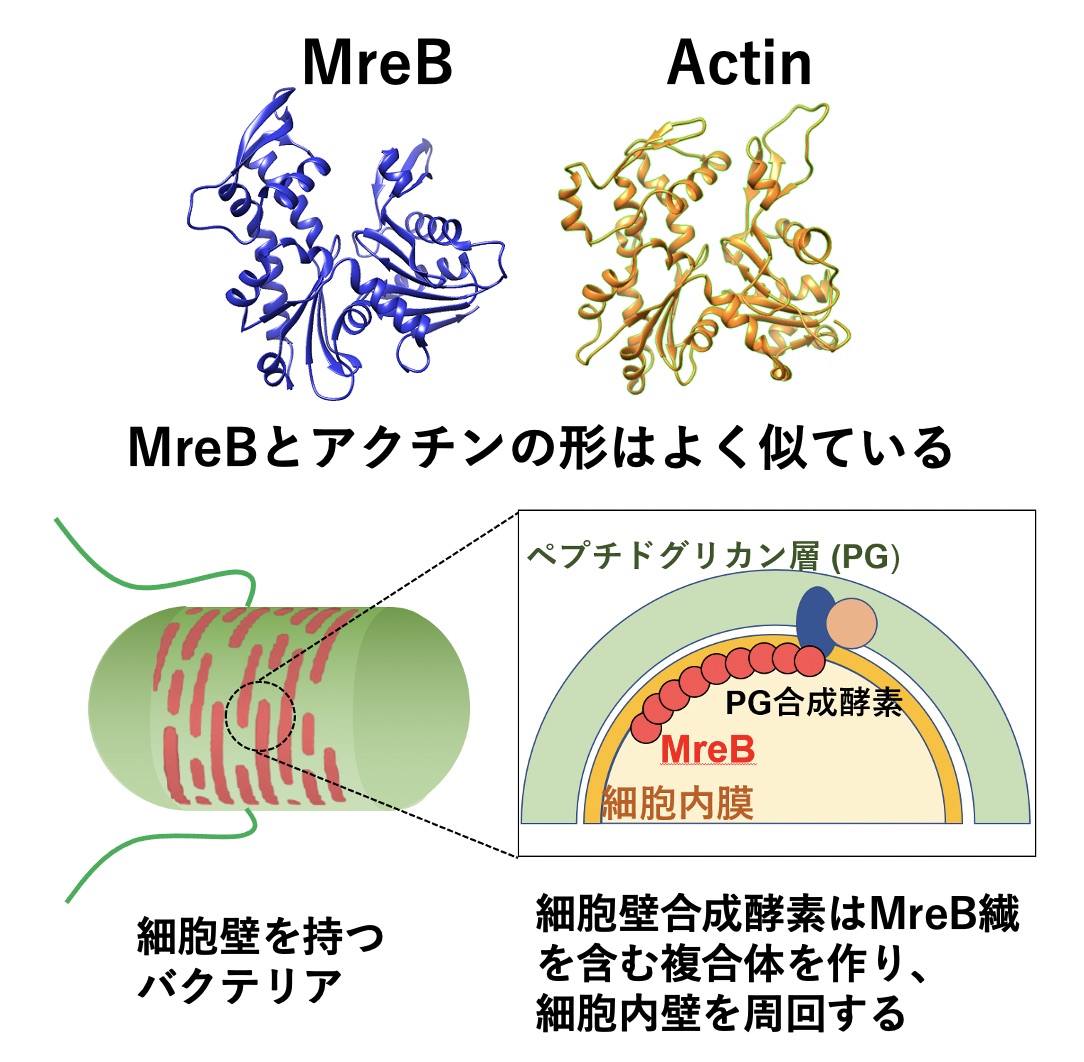
図3:大腸菌を含む桿菌の中を周回して、細胞壁(ペプチドグリカン層)の合成酵素の足場として働くMreBの模式図。最近、MreBを別の目的に使うバクテリアが見出されつつある(大阪公立大学・宮田真人研究室との共同研究)。
