分子生物物理学研究室
蛋白質がなぜ決められた立体構造を作ることができるのか、特定の分子だけを強力に結合することができるのか、ある化学反応だけを迅速に進めることができるのかなどの蛋白質分子に関係する、数々の興味深い機構を分子レベルで明らかにする。このため、高精度示差走査熱量測定や等温滴定型熱量測定などの精密熱測定、円二色性や吸収・蛍光スペクトルなどの分光測定、質量分析などの各種の物理化学的測定法を用いている。また、立体構造に基づいて、より高機能な蛋白質分子を設計し、酵母や大腸菌などにより調製し、機能評価を行うことで、高機能生体ナノマシンの創製をめざしている。これまでに産業用酵素の活性を10倍に高めたり、耐熱性を20℃高めるたりすることに成功している。
スタッフ
教授 城所 俊一
助教 今井 栄一
研究プロジェクト
- 1.低温ショック蛋白質と一本鎖核酸との相互作用機構の解明とその応用
- 蛋白質分子が一本鎖核酸の塩基配列を識別し、強力に結合するメカニズムを明らかにするために、低温ショック蛋白質とオリゴDNAとの結合を、高精度の等温滴定型熱量計(ITC)を使って熱力学的に評価する。また、結合する時の立体構造の変化を、X線結晶解析で明らかにすることで、原子レベルで、立体構造と分子機能との関係を明確にする。また、この分子機能を生かして、低温ショック蛋白質を遺伝子操作の際の新しい高機能試薬として応用することをめざしている。
- 2.洗剤用酵素の失活機構と速度論的安定性
- 溶液中で蛋白質を保存しておくと、だんだんと活性が下がってゆくことが知られている。洗剤用の酵素などでも、保存中などに酵素活性が低下することが問題になっているが、そのメカニズムは不明な点が多く、また失活を熱力学的に精密に評価する技術も確立されていない。高精度示差走査熱量計(DSC)を使って、蛋白質の速度論的な安定性を熱力学的に評価する方法を開発するとともに、実際に洗剤に使用されている酵素を使って失活の機構を明らかにする。この知見を用いて、酵素をより安定に使用する方法を提案する。
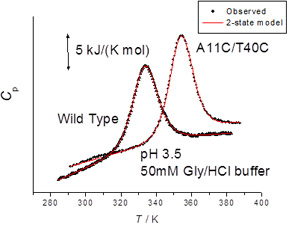
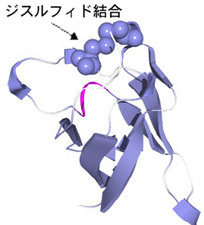
- 3.物理的摂動法による蛋白質の高機能化
- 立体構造に基づいて、分子表面にジスルフィド結合を新たに導入するための分子設計法を確立するとともに、耐熱化を定量的に予測することをめざしている。実際に分子表面にジスルフィド結合を導入した蛋白質の熱安定性をDSCを用いて精密に測定するとともに、X線結晶解析などで立体構造の微小な変化を評価し、安定化の機構を原子レベルで予測する。また、蛋白質の活性部位の静電ポテンシャルを変化させることで、蛋白質分子の機能を高めることが可能であり、バイオマスなどへの応用が期待されているセルラーゼなどの酵素の活性を高めることをめざしている。
- 4.酵素反応を用いたATPの高エネルギー機構の解明
- 地球上の生物共通のエネルギー通貨・ATPの高エネルギーリン酸結合については、熱力学的には不明な点が多く、pH・温度・共溶媒の存在などの様々な溶媒条件下で、ATPの加水分解に伴う熱力学的変化を評価することが必要とされている。ATP分解酵素反応を精密熱測定を使って評価すること、またATPやADPの熱力学的な特性を評価することで、ATPのエネルギーについての分子論的な評価を行う。これまでに、ITCを用いた反応エンタルピーの精密評価に成功している。
 教授 城所 俊一 |
 助教 今井 栄一 |